Dãy điện hóa: Từ Cơ bản đến Nâng cao
Bài viết được cung cấp bởi Trung Tâm Gia sư IJSER – Đơn vị uy tín trong lĩnh vực giáo dục
I. Giới thiệu về dãy điện hóa
Dãy điện hóa là một trong những khái niệm quan trọng nhất trong hóa học, đặc biệt là trong lĩnh vực điện hóa học. Dãy này sắp xếp các cặp oxi hóa – khử theo thứ tự tăng dần của điện thế điện cực chuẩn (E°), cho phép chúng ta dự đoán và giải thích nhiều hiện tượng hóa học quan trọng trong cuộc sống.

II. Cơ sở lý thuyết
1. Định nghĩa
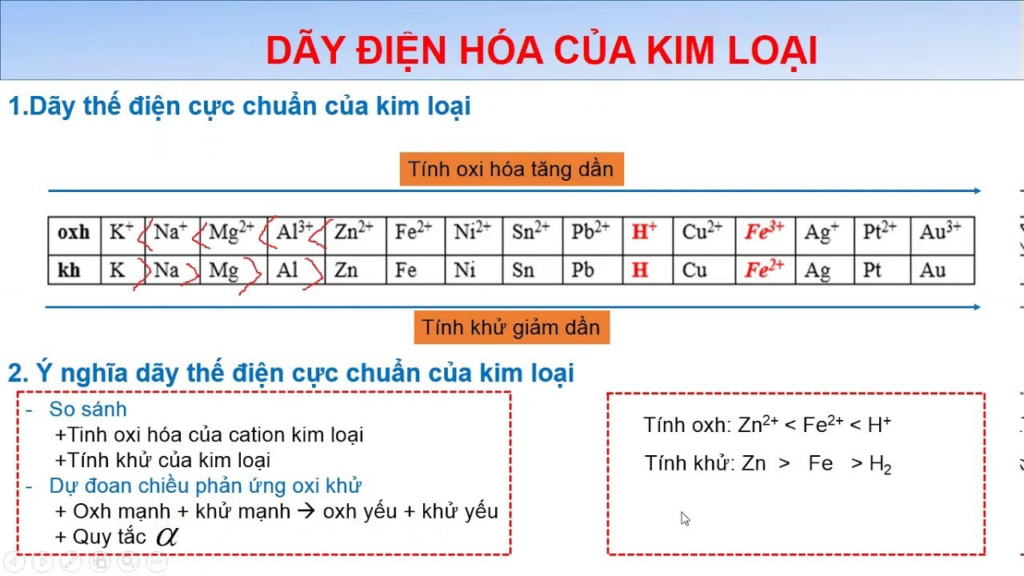
Dãy điện hóa là bảng sắp xếp các cặp oxi hóa – khử theo thứ tự tăng dần của điện thế điện cực chuẩn (E°). Trong đó:
- Các kim loại được sắp xếp theo chiều giảm dần tính khử (tăng dần tính oxi hóa)
- Các phi kim được sắp xếp theo chiều tăng dần tính oxi hóa
2. Cấu tạo của dãy điện hóa
Dãy điện hóa tiêu chuẩn bao gồm:
- Các kim loại: Li, K, Ba, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, H, Cu, Ag, Hg, Pt, Au
- Các phi kim: F₂, Cl₂, Br₂, I₂
- Ion H⁺ được chọn làm gốc với E° = 0V
III. Ý nghĩa và ứng dụng
1. Dự đoán khả năng phản ứng
Dãy điện hóa cho phép chúng ta:
- Dự đoán khả năng xảy ra phản ứng giữa kim loại với dung dịch muối
- Xác định chiều phản ứng oxi hóa – khử
- Tính toán điện thế pin điện hóa
2. Ứng dụng trong thực tế
a. Trong công nghiệp
- Điện phân nước sản xuất H₂ và O₂
- Điện phân muối nấu để sản xuất NaOH, Cl₂
- Tinh luyện kim loại
- Mạ điện
b. Trong đời sống
- Pin và ắc quy
- Chống ăn mòn kim loại
- Xử lý nước thải

IV. Các quy luật quan trọng
1. Quy tắc dịch chuyển electron
- Kim loại đứng trước sẽ đẩy được kim loại đứng sau ra khỏi dung dịch muối của nó
- Phi kim có tính oxi hóa mạnh hơn sẽ đẩy được phi kim có tính oxi hóa yếu hơn ra khỏi hợp chất của nó
2. Các yếu tố ảnh hưởng
- Nhiệt độ
- Nồng độ dung dịch
- Điều kiện bề mặt kim loại
- pH của môi trường
V. Bài tập minh họa
Bài tập 1:
Cho dãy điện hóa: Fe/Fe²⁺//Cu²⁺/Cu
Hãy xác định:
a) Cực dương, cực âm
b) Chiều dịch chuyển electron
c) Các phản ứng xảy ra tại điện cực
Lời giải:
a) Cực âm: Fe/Fe²⁺ (E°₁ = -0,44V)
Cực dương: Cu²⁺/Cu (E°₂ = +0,34V)
b) Electron dịch chuyển từ cực âm (Fe) đến cực dương (Cu²⁺)
c) Tại cực âm: Fe → Fe²⁺ + 2e⁻
Tại cực dương: Cu²⁺ + 2e⁻ → Cu
VI. Lời khuyên cho học sinh
- Ghi nhớ vị trí tương đối của các kim loại và phi kim quan trọng trong dãy điện hóa
- Hiểu rõ ý nghĩa của việc sắp xếp theo thứ tự tăng dần điện thế điện cực chuẩn
- Thực hành nhiều bài tập để nắm vững các quy luật
- Liên hệ với các hiện tượng trong thực tế để hiểu sâu hơn
VII. Kết luận
Dãy điện hóa là một công cụ quan trọng trong việc học và nghiên cứu hóa học. Việc nắm vững kiến thức về dãy điện hóa sẽ giúp học sinh:
- Hiểu được bản chất của các phản ứng oxi hóa – khử
- Dự đoán được khả năng xảy ra phản ứng
- Giải thích được nhiều hiện tượng trong tự nhiên
- Ứng dụng được trong các bài toán thực tế
Để được tư vấn và hỗ trợ thêm về môn Hóa học cũng như các môn học khác, vui lòng liên hệ:
Trung Tâm Gia sư IJSER
- Hotline: 0909 223 113
- Email: [email protected]
- Website: ijsernet.org
Trung tâm Gia sư IJSER tự hào là đơn vị cung cấp dịch vụ gia sư uy tín, chất lượng với đội ngũ giáo viên giàu kinh nghiệm, tận tâm. Chúng tôi cam kết mang đến cho học sinh những kiến thức nền tảng vững chắc và phương pháp học tập hiệu quả.